 Sie wollen doch nicht etwa vor der Komplexität der Regelwerke und den Schwierigkeiten bei der Umsetzung der dort formulierten Anforderungen kapitulieren ?
Sie wollen doch nicht etwa vor der Komplexität der Regelwerke und den Schwierigkeiten bei der Umsetzung der dort formulierten Anforderungen kapitulieren ?
Wir helfen Ihnen, Ihre Abläufe bei der pharmazeutischen und klinischen Entwicklung regulatorisch "hieb- und stichfest" und gleichzeitig beherrschbar in Bezug auf Zeit- und Resourcenbedarf (Personal, Anlagen, Kosten) zu machen.
Wir führen Sie durch das Labyrinth der Anforderungen und helfen Ihnen nicht nur hinein sondern in einer Weise auch wieder heraus, dass Sie sich fragen werden, warum Sie nicht schon früher so vorgegangen sind.
Wir stellen uns unerschrocken jeder regulatorischen Herausforderung in der Entwicklungsphase - sei es bei der Umsetzung der Anforderungen, dem Training der relevanten Mitarbeiter oder der praktischen Übernahme von Funktionen.
Haben Sie beispielsweise gewusst, dass die "neumodische" und "schikanöse" Forderung nach einem DoE in der ICH Richtlinie Q8 garnicht "neumodisch" ist ? Das jetzt DoE (Design of Experiments) genannte Vorgehen ist nämlich bereits seit 1937 bekannt (es hieß damals eben nur anders: nämlich "Factorial Design"). Da es damals noch keine Computer und Taschenrechner gab, muss es also auch ohne gegangen sein - auf Papier ! Wir zeigen Ihnen in wenigen Minuten (!) wie es geht.
Beispiel: die EU GCP Regulation und klinische Prüfpräparate
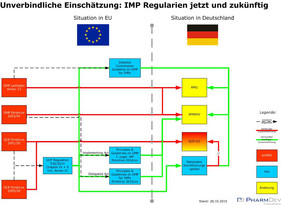
Die GCP Regulation 536/2014 wirft ihre Schatten mit zahlreichen neuen abgeleiteten Regelwerken voraus und die Nachfrage hat gezeigt: nur die wenigsten blicken durch !
Wissen Sie, was ein "Delegated Act" und ein "Implementing Act" in der EU Gesetzgebung sind ?
Kennen Sie den Unterschied zwischen "Regulation", "Commission Guideline" und "Directive" ?
Zu allen diesen drei Kategorien wurden im Anschluss an und in Verbindung mit der EU GCP Regulation neue Regelwerke im Entwurf bekannt gemacht, die praktisch und regulatorisch auf EU-Ebene und national deutliche Auswirkungen für die Bereitstellung klinischer Prüfpräparate haben werden.
So wurde jetzt die Absicht bekannt, den EU-GMP Annex 13 durch eine Detailed Commission Guideline abzulösen und zudem die Direktive 2003/94 durch einen (oder zwei ?) sog. Delegated Act(s) zu ersetzen.
In Folge ergibt sich aus dem geplanten Änderungsgesetz zum deutschen Arzneimittelgesetz, dass die AMWHV und die GCP-Verordnung in Deutschland für die meisten Prüfpräparate nicht mehr zur Anwendung kommen sollen !
Im Rechtsetzungsverfahren der EU erkennen wir in der "delegierten Rechtsakte" das Schlupfloch für den Gesetzgeber: wenn tatsächlich in den Details "Nachbesserungsbedarf" besteht, wird die EU Kommission ermächtigt, über eine delegierte Rechtsakte gewisse Details näher zu regeln.
Diese Ermächtigung ist in der EU GCP Verordnung explizit in Artikel 63 für Herstellung und Einfuhr und in Artikel 70 für die Kennzeichnungsvorgaben in Annex VI formuliert:
Artikel 70 Delegierte Rechtsakte
Der Kommission wird die Befugnis übertragen, gemäß Artikel 89 in Bezug auf die Änderung des Anhangs VI zur Gewährleistung der Sicherheit der Prüfungsteilnehmer und der Zuverlässigkeit und Belastbarkeit der im Rahmen einer klinischen Prüfung gewonnenen Daten oder zur Anpassung an den technischen Fortschritt delegierte Rechtsakte zu erlassen.
Wenn Sie sich durch das komplexe Thema nicht selbst durchwühlen möchten, sorgen wir für Transparenz auf einer unserer Veranstaltungen oder verschaffen Ihnen persönlich und angepasst auf Ihre Situation den entsprechenden Durchblick (in diesem Falle senden Sie uns doch einfach eine e-mail).
Dr. Rango Dietrich Gern erwarte ich Ihren Anruf ! Tel +49 (0)40 5730 9912 Mail info@pharmdev.deKontakt:



